Beskjeden fra fagmiljøet var temmelig unison: Det der er ikke mulig å få til. Men professor Johanna Olweus hadde trua.
– Noen ganger hjelper det å være litt naiv, smiler Olweus, forskningsleder på K. G. Jebsen senter for immunterapi mot kreft på Institutt for kreftforskning ved Universitetet i Oslo og Oslo universitetssykehus, Radiumhospitalet.
Voldsom avstøting
Ideen skulle vise seg å være god, og ikke bare det: den har potensial til å bringe immunterapien et langt steg videre.
For noen kan det å få operert inn et nytt organ fra en donor – hjerte, lunge eller nyre – være redningen når egne organer svikter. Kroppens naturlige reaksjon er å støte fremmedlegemet bort, ja regelrett destruere det. Det skyldes en kraftig immunrespons – som heldigvis kan dempes med medisiner.
"Så det er virkelig sånn at T-cellene ikke bare kan få et organ til å forsvinne, de kan faktisk også få kreft til å forsvinne!"
Er det mulig å utnytte denne responsen og bruke immunceller fra friske til å drepe kreftceller hos pasienter? Ja, det har Olweus og kollegene hennes nå bevist er mulig. De har greid å sette immunceller i stand til å opptre som varmesøkende missiler, som effektivt kan destruere kreftcellene uten å samtidig skade friske celler. Her snakker vi om kirurgi på cellenivå.
De beste
Oppdagelsen har gitt publisering i prestisjetunge Science, PNAS og Nature Protocols – og framfor alt et såkalt ERC-stipend, en kraftig anerkjennelse og 20 millioner kroner fra Det europeiske forskningsrådet.
Prosjektet OUTSOURCE er akkurat startet opp, og Johanna og hennes gruppe på 15 skal de neste fem årene ta forskningen et langt steg videre mot klinikken og alvorlig syke pasienter – med kreft og uten håp.
Det største som har skjedd
Immunterapien regnes som det største om har skjedd innen kreftbehandlingen de siste ti-femten årene, og satsingen på feltet er enorm over hele verden. Vi har hørt historiene om de nesten mirakuløse behandlingsresultatene, hvor dødelig syke kreftpasienter får livet tilbake.
– Men ennå mangler en helbredende behandling for de aller fleste av pasientene som har kreft med spredning. Vi håper å kunne gjøre noe med dette gjennom forskningen vår, sier Olweus.
To ulike strategier for immunterapi er nå en del av standard behandling av kreftpasienter; såkalt sjekkpunkthemming og immungenterapi.
Bremser immunsystemet
– Sjekkpunkthemming var den første effektive immunterapien mot kreft. Kreftcellene er lure. De har utviklet en måte å hemme immuncellene på, slik at de ikke får gjort jobben.
– Kreftcellene har molekyler på overflaten som kan skru på bremser hos kroppens immunceller.
Sjekkpunkthemmerne blokkerer bremsene til immunsystemet som kreften har satt på. Dermed oppheves hindringen for immuncellene, og T-celler som gjenkjenner kreftcellene som fremmede, blir i stand til å drepe dem.
Forskerne bak prinsippet fikk Nobelprisen i medisin i 2018.
– Sjekkpunkthemmere har gitt nye muligheter til å forlenge livet og forbedre prognosen til pasienter som har kreft med spredning – kreftformer som vi tidligere hadde veldig lite å tilby, som føflekkkreft, lungekreft og nyrekreft. Men flertallet av pasientene som behandles, får dessverre tilbakefall og dør av sin kreftsykdom, erkjenner forskeren.
Det er behov for å finne behandling som gjør pasienten helt frisk.
Kampkraft fra friske
Og da kommer vi inn på den andre formen for immunterapi – immungenterapi.
– Den behandlingsformen som til nå har hatt størst gjennomslag innen immungenterapi, er det som kalles CAR 19 T-celleterapi. I motsetning til sjekkpunkthemming er denne behandlingen ikke avhengig av kreftpasientens eget immunsystem.
Olweus peker på at immunsystem og kreft utvikler seg i et gjensidig samspill og over lengre tid, og at det er derfor immuncellene blir hemmet. Hos kreftpasienter er immunforsvaret svekket – nettopp når et aggressivt og kampvillig forsvar trengs som mest for å få bukt med sykdommen.
Men hva om det går an å låne kampkraft fra immunforsvaret til en som er frisk – for å styrke T-cellene, immunsystemets fotsoldater?
– Det er nettopp det som gjøres ved en CAR 19 T-celleterapi. CAR står for Chimeric Antigen Receptors.
Reseptorene opptrer som ‘følere’ som kan gjenkjenne bestemte molekyler på kreftcellene, forklarer hun.
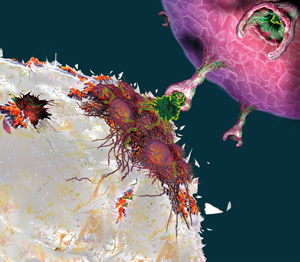
T-celler, immunforsvarets fotsoldater, er hentet ut fra pasientens blod. På laboratoriet er de blitt utstyrt med gener fra en frisk person som koder for kunstige immunreseptorer – som gjør at de målstyres mot kreftcellene og dreper dem. Foto: NTB Scanpix
Ved immungenterapi utstyres immunceller med gener som koder for kunstige immunreseptorer – CARs – som gjør at de målstyres mot kreftcellene og dreper dem.
Immunreseptorene stammer fra antistoffer som opprinnelig ble laget i mus, og som deretter
er modifisert genetisk slik at de er i stand til å overføre signaler. Forskeren forklarer prosedyren:
– T-celler fra blodet til pasienten tas ut. I laboratoriet blir cellene oppformert og genene som koder for immunreseptoren, overføres ved hjelp av et virus. Så settes de genetisk modifiserte T-cellene tilbake i blodet til pasienten. Når antistoff-delen av et CAR-molekyl binder seg til sitt mål på kreftcellen, blir den genmodifiserte immuncellen aktivert og kan drepe kreftcellen.
Dreper også de friske
Det molekylet skytset rettes mot, er det såkalte CD19-molekylet som finnes i cellemembranen til B-celler. B-celler er cellene som produserer antistoffer.
Men CD19-molekylene finnes dessverre også på normale B-celler og ikke bare de ondartete. Derfor blir også de friske cellene drept i samme slengen.
– CD19 er et utrolig godt mål, fordi det finnes mye av dette molekylet på utsiden av kreftcellen. Uheldigvis finnes de også på normale celler. Men heldigvis tåler vi å være uten B-celler. Derfor kan vi drepe både de ondartete cellene og de normale cellene som kreften utgår fra, uten å skade pasienten alvorlig, påpeker Olweus, og legger til at det selvsagt ikke er noen fordel å leve uten B-celler.
– Men de kan kompenseres for gjennom å tilføre antistoffer, som B-cellene normalt produserer.
Ikke fått det til
For mange av pasientene med såkalt B-cellekreft, som er lymfekreft og akutt blodkreft, har denne behandlingen betydd en revolusjon.
– Det ser ut til at 40 prosent av dem er helbredet, forteller Olweus.
Når dette har fungert så godt for B-cellekreft, hvorfor ikke utvikle tilsvarende konsept for andre kreftformer?
– Det har en prøvd i mer enn ti år, men ennå ikke fått til. Hovedårsaken er at det er vanskelig å finne andre og like gode mål som CD19-molekylet.
Behovet for å oppspore andre mål på kreftcellene – og immunreseptorer som gjenkjenner disse – er derfor stort, understreker Olweus.
Finner mål overalt i cellen
Olweus og kollegene ser derfor heller etter T-cellereseptorer. CAR kan bare gjenkjenne molekyler på celleoverflaten.
Det er et problem fordi over 90 prosent av cellens proteiner sitter inne i cellen.
– Det er der forskningen vår kommer inn. For vi bruker en annen immunreseptor, som er en T-celle-reseptor, forteller Olweus.
T-celler er utstyrt med reseptorer som kan gjenkjenne mål uavhengig av hvor i målcellen de befinner seg.
Prinsipp fra transplantasjon
T-celler skal normalt bare reagere på det som er fremmed – de gjenkjenner for eksempel en virusinfisert celle som fremmed fordi cellen da vil vise fram proteinfragmenter fra virus. Men T-cellene skal ikke gjenkjenne cellens egne, normale proteiner – da hadde vi alle hatt såkalte autoimmune sykdommer, som leddgikt, MS, diabetes type 1 og cøliaki.
Under utviklingen av immunsystemet vårt blir derfor slike selv-reaktive T-celler fjernet.
– I utgangspunktet kan vi derfor ikke identifisere T-cellereseptorer i pasienten selv som kan gjenkjenne normale proteiner, til tross for at det finnes mye av dem i kreftceller.
Kan det være mulig å omgå dette problemet?
Olweus fikk en idé fra organtransplantasjon.
– I organtransplantasjon er en ikke spesielt nøye med å matche vevstypen til pasient og giver. Det går allikevel bra – organet blir ikke avstøtt så lenge pasienten står på immunhemmende behandling, påpeker hun.
Kreften forsvant
Et nytt organ kan bli redningen for noen. Men av og til oppstår nye problemer.
Det nye organet kan få kreft. Kreften kan til og med ha spredd seg. Hva da? Pasienten slutter å ta de immunhemmende medisinene sine, og dermed utstøtes det syke organet. Og hvem er som regel nissen på lasset? Jo, kreftcellene som kan ha spredd seg rundt i kroppen.
– Det var dette som gjorde at jeg tenkte: Så det er virkelig sånn at T-cellene ikke bare kan få et organ til å forsvinne, de kan faktisk også få kreft til å forsvinne! Om vi greier å finne de molekylære mekanismene bak det hele, ja, da kan prinsippet kanskje brukes i kreftbehandlingen?
Det er denne avstøtingsmekanismen, basert på en «mismatch» i vevstype, som forskerne utnytter til å lage nye T-cellereseptorer som gjenkjenner normale proteiner.
– Proteinene er spesifikke for en gitt celletype og kreftcellene som utgår fra denne celletypen. T-cellereseptorene vi lager, vil derfor kunne brukes til å behandle kreft i organer som i utgangspunktet kan fjernes kirurgisk, som prostata, eggstokker, blære, bryst og bukspyttkjertel, påpeker Olweus.
Finner mye angrepsmål
– Vi har dessuten en teknologi for å identifisere nye mål, fortsetter hun.
– Vi trenger virkelig gode og spesifikke mål å rette angrepene mot for at pasienten skal få så få og svake bivirkninger som mulig – og så god effekt av behandlingen som mulig.
Olweus og forskergruppen hennes leter etter mål, steder å rette angrepene mot, som finnes i kreftcellene – og ikke på normale og uunnværlige celler i kroppen.
Istedenfor å rette seg mot proteiner på kreftcellens utside, slik CAR gjør, retter forskerne seg mot proteiner inne i cellene. Hver celletype, enten det er blodcelle, nyrecelle eller levercelle, har bestemte proteiner som er typiske for akkurat den celletypen. Disse proteinene forsvinner som regel ikke selv om cellen utvikler seg til en kreftcelle og sprer seg til en annet organ. Derfor kan disse proteinene være gode mål for angrep.
– Den viktigste helbredende kreftbehandlingen vi har i dag, er faktisk kirurgi, minner Olweus om.
For å kurere brystkreft, prostatakreft, til og med bukspyttkjertelkreft, må ofte organet bort. Vi kan klare oss uten disse organene. Men om kreftcellene har spredd seg til beinmarg eller infiltrert mange andre organer, da er kirurgi ikke lenger aktuell.
De cellespesifikke markørene som er på det organet som kreften utgår fra, vil ofte holde seg på de kreftcellene som har spredt seg. Hvis T-cellene kan gjenkjenne dem, kan de utføre ‘kirurgi’ på enkeltcellenivå.
– T-cellene kan oppsøke kreftcellene hvor enn de befinner seg. Om vi da har et godt mål og en god T-cellereseptor, så er det mulig å drepe kreftcellene der de er, selv om de har infiltrert andre organer, sier hun.
– Fordi vi målretter oss mot molekyler som er spesifikke for gitte celletyper, så vil en framtidig behandling kunne brukes ved kreftformer som oppstår i organer som vi kan leve uten.
Prøver ut i pasienter
Olweus og kollegene har altså utviklet en teknologi for å identifisere nye, gode immunreseptorer og nye mål. Teknologien er patentbeskyttet.
I Outsource-prosjektet vil teknologien bli brukt til å finne flere gode T-cellereseptorer – som kan brukes til å behandle forskjellige kreftformer og til å demonstrere effekt i dyremodeller. Gruppen har allerede utviklet noen T-cellereseptorer som de har stor tro på og som de ønsker å ta videre inn i klinikk.
Olweus roser kollegene sine.
– Jeg har en enormt dyktig forskergruppe med høy kompetanse og som er i stand til å gjøre det eksperimentelle arbeidet. Både på cellenivå og molekylært nivå er det svært krevende, understreker hun.
– Det er nemlig ikke bare å ha ideene, ideene må ned på det praktiske plan. Nå planlegger vi de første utprøvingene med pasienter.
Kombinerer flere behandlinger
Johanna Olweus ser for seg at kreftbehandlingen framover blir stadig mer persontilpasset, og at immunterapien kan kombineres med annen behandling, som cellegift og stråling – for å oppnå størst mulig effekt.
– Det tror jeg kan bli viktig også for T-cellereseptor-terapi. Kanskje blir det aktuelt å ikke bare bruke én T-cellereseptor, men flere sammen som binder seg til forskjellige mål i kreftcellen, sier Johanna Olweus, og minner om at det ennå gjenstår mye arbeid for å gi kroppens forsvar kraft nok til å gjøre oss friske.
– Håpet er at vi i framtiden kan kurere kreft like effektivt som immunforsvaret kan kurere influensa.


Logg inn for å kommentere
Ikke UiO- eller Feide-bruker?
Opprett en WebID-bruker for å kommentere